Índex del dossier del 3r trimestre. Aquí.
Coneix els projectes de ciències fets fins ara a l'ESO al nostre blog FEM CIÈNCIA. Clica aquí.
Vols fer experiments i saber-ne l'explicació científica? Aquests webs t'ajudaran:
Coneix els projectes de ciències fets fins ara a l'ESO al nostre blog FEM CIÈNCIA. Clica aquí.
Vols fer experiments i saber-ne l'explicació científica? Aquests webs t'ajudaran:
APRENC PERQUÈ VULL*
*Títol inspirat en el llibre de J. Vergara
EL DISSENY EXPERIMENTAL
Apartats de l'informe de disseny experimental treballat a classe. Clica aquí.
Per ser un bon científic/a, has de dominar el disseny experimental. Clica aquí!
Com fer l'informe de disseny experimental. Clica aquí.
Com triar si fer un gràfic de barres o un gràfic linial. Variable contínues i discretes. Clica aquí.
Science-bits: http://www.science-bits.com/
Per ser un bon científic/a, has de dominar el disseny experimental. Clica aquí!
Pel·lícula: "Marie Curie" 2016
Apunts de Física i Química 3r ESO:
Tema 1. Els àtoms. L'àtom. La taula periòdica.
Conceptes de repàs
1) L'àtom està format per 2 parts: ................ i ................... .
2) A l'escorça hi ha els .................. i al nucli i ha .................... i ................. .
3) Els electrons tenen càrrega ......................, els protons càrrega .................. i els neutrons càrrega ................ .
MIRA LA TAULA PERIÒDICA
4) El nombre atòmic o Z és el nombre de ...................... que té l'àtom al nucli. És el nombre d'ordre en la taula periòdica. És únic per a cada àtom. Digues el nombre atòmic de: O, C, Li.
5) El nombre màssic o A és el nombre de ........................ més ................... del nucli. Digues el nombre màssic de: O, C, Li.
6) Un àtom d'oxigen neutre té els mateixos protons (+) que electrons(-). Digues quants p i n tenen els àtoms neutres següents: O p(+)...... e(-)....... / C p(+)...... e(-)......... /Li p(+)....... e(-)....... .
7) Un ió catió és un àtom que ha perdut electrons. Li+ ha perdut ..... electró. Be2+ ha perdut ...... electrons. Fe3+ha perdut ....... electrons.
8) Un ió anió és un àtom que ha guanyat electrons.
9) 126C : àtom de carboni amb nombre atòmic ..................... i nombre màssic ................... Té ............ neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té ...................... electrons.
10) 83Li : àtom de liti amb nombre atòmic ............ i nombre màssic ............. Té ............ neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té ........... electrons.
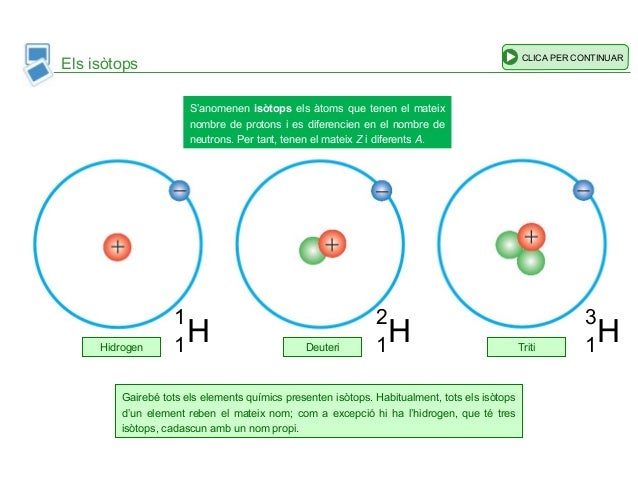
11) Un isòtop té mateixos protons i diferents neutrons. Busca a aquesta pàgina web:
3 isòtops del carboni
3 isòtops de l'oxigen
3 isòtops de l'hidrogen
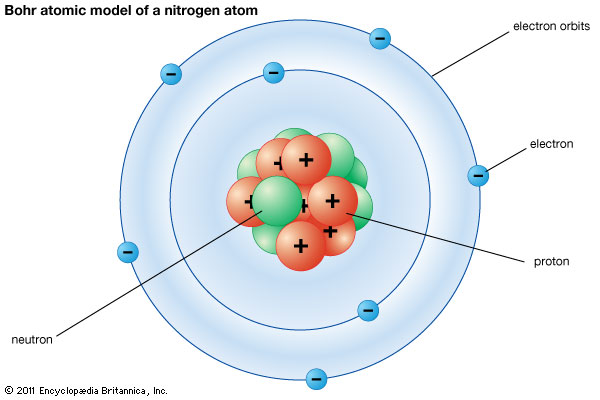
1) Parts i partícules de l'àtom
Taula periòdica.
The periodic table song
Parts de l'àtom: escorça i nucli
Àtom d'heli - He
Àtom de liti - Li
Àtom de nitrogen - N
Si un àtom guanya electrons es converteix en ANIÓ i queda carregat negativament (Cl passa a Cl-1, S passa a S-2, P passa a P-3).
Si un àtom perd electrons es converteix en CATIÓ i queda carregat positivament (Li passa a Li+1, Ca passa a Ca+2, Fe passa a Fe+3).
2) Nombre atòmic i nombre màssic
Font: https://geolodiaavila.com/wp-content/uploads/2019/03/isotopo_carbono.jpg
Isòtops radioactius:
Bomba atòmica 2a Guerra Mundial llançada sobre Japó 6 - 9 agost 1945. Bombes atòmiques d'Hiroshima. d'Urani-235. Nagasaki Plutoni-239.
Accident de la central nuclear de Txernòbil 26 abril 1896 Ucraïna. Urani-235.
4) Com s’escriu el símbol, nombre atòmic, i nombre màssic?
126C : àtom de carboni amb nombre atòmic 6 (6 protons) i nombre màssic 12 (12 protons més neutrons). Té 12-6=6 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 6 electrons.
136C: àtom de carboni amb nombre atòmic 6 i nombre màssic 13. Té 13-6=7 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 6 electrons.
146C: àtom de carboni amb nombre atòmic 6 i nombre màssic 14. Té 12-6=8 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 6 electrons.
63Li : àtom de liti amb nombre atòmic 3 (3 protons) i nombre màssic 6 (6 protons més neutrons) . Té 6-3=3 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 3 electrons.
73Li : àtom de liti amb nombre atòmic 3 i nombre màssic 7. Té 7-3=4 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 3 electrons.
83Li : àtom de liti amb nombre atòmic 3 i nombre màssic 8. Té 8-3=3 neutrons. Si l’àtom és neutre o amb càrrega elèctrica “0” vol dir que té 3 electrons.
5) Atoms neutres i ions (àtoms que guanyen o perden electrons MAI PROTONS!!!)
Àtom neutre: mateix nombre de protons que d’electrons.
Ió positiu o catió: àtom que perd electrons. Li+1 : càrrega +1.
Ió negatiu o anió: àtom que guanya electrons. S-2: càrrega -2.
Protons: càrrega positiva
Electrons: càrrega negativa
S: àtom neutre. Té 16 protons i 16 electrons. (mireu Taula periòdica)
S-2: ió anió que guanya 2 electrons. Té 16 protons i 18 electrons.
P: àtom neutre. Té 15 protons i 15 electrons. (mireu Taula periòdica)
P-3: ió anió que guanya 3 electrons. Té 15 protons i 18 electrons.
Li: àtom neutre. Té 3 protons i 3 electrons. (mireu Taula periòdica)
Li+1: ió catió que perd 1 electró. Té 3 protons i 2 electrons.
Ba: àtom neutre. Té 56 protons i 56 electrons. (mireu Taula periòdica)
Ba2+:: ió catió que perd 2 electrons. Té 56 protons i 54 electrons.
6) LA TAULA PERIÒDICA
Com s'han format els elements de la Taula Periòdica? El seu origen còsmic.
Som "polvo de estrellas"? http://www.microsiervos.com/archivo/ciencia/tabla-elementos-origen-universo.html
Formació de l'or i altres elements
http://www.elmundo.es/ciencia-y-salud/ciencia/2017/10/25/59ef687b46163fb87c8b470b.html (2a part)
http://www.abc.es/ciencia/abci-descubren-origen-mayoria-litio-universo-201611040312_noticia.html
La fi del planeta Terra, què passarà?
https://elpais.com/elpais/2016/12/08/ciencia/1481216786_829175.html
https://es.wikipedia.org/wiki/Futuro_de_la_Tierra
Aquí trobareu la taula periòdica.
Com s'han format els elements de la Taula Periòdica? El seu origen còsmic.
Som "polvo de estrellas"? http://www.microsiervos.com/archivo/ciencia/tabla-elementos-origen-universo.html
Formació de l'or i altres elements
http://www.elmundo.es/ciencia-y-salud/ciencia/2017/10/25/59ef687b46163fb87c8b470b.html (2a part)
http://www.abc.es/ciencia/abci-descubren-origen-mayoria-litio-universo-201611040312_noticia.html
La fi del planeta Terra, què passarà?
https://es.wikipedia.org/wiki/Futuro_de_la_Tierra
Aquí trobareu la taula periòdica.
D'on vénen els noms de la taula periòdica?
http://www.uv.es/~jaguilar/elementos/nombres.html
Juguem amb la taula periòdica
http://www.taulaperiodica.upc.edu/
"Ptable song"
La taula periòdica a la vida diària:
La taula periòdica a la vida diària:
Un vídeo per a cada element de la taula periòdica:
7) Reacció química, reacció nuclear de fissió, reacció nuclear de fusió.
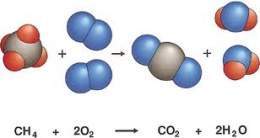
Reacció química (els àtoms inicials i finals són els mateixos però es combinen per formar compostos diferents al principi i al final)
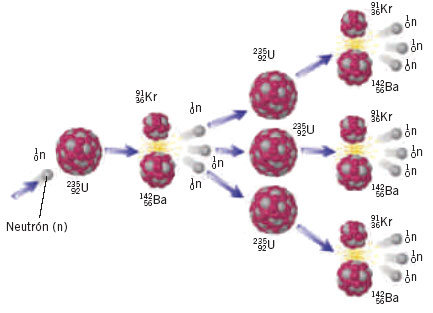
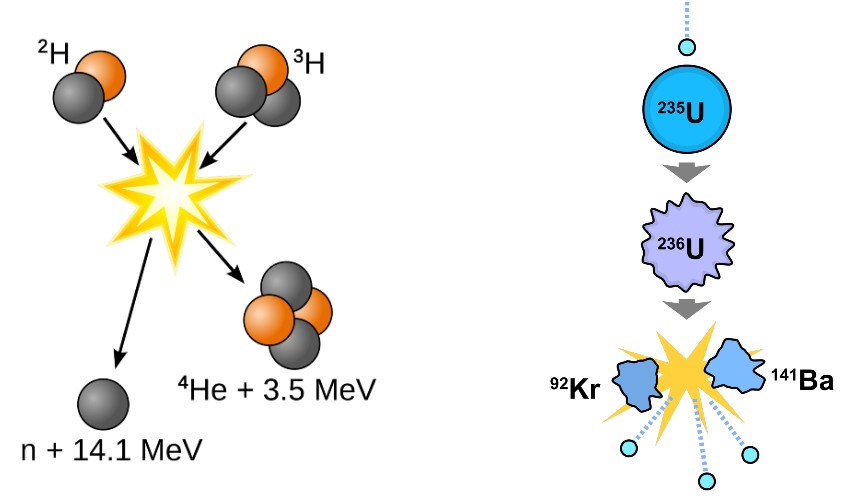
Reacció nuclear de fissió (1 àtom inicial i 2 de àtom finals diferents a l'inicial)
Reacció nuclear de fusió (2 àtoms inicials i 1 àtom final diferent als inicials)
1) REACCIÓ QUÍMICA (Els àtoms no varien, es recombinen)
2) REACCIÓ NUCLEAR DE FUSIÓ I FISSIÓ. Els àtoms es transformen en àtoms diferent perquè el seu nucli (nombre de protons) canvia.
Font: https://culturayciencia.diariocronicas.com/wp-content/uploads/2020/08/Diferencias-entre-fision-y-fusion-nuclear.jpg
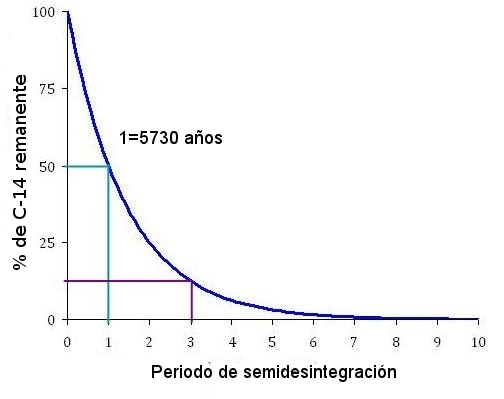
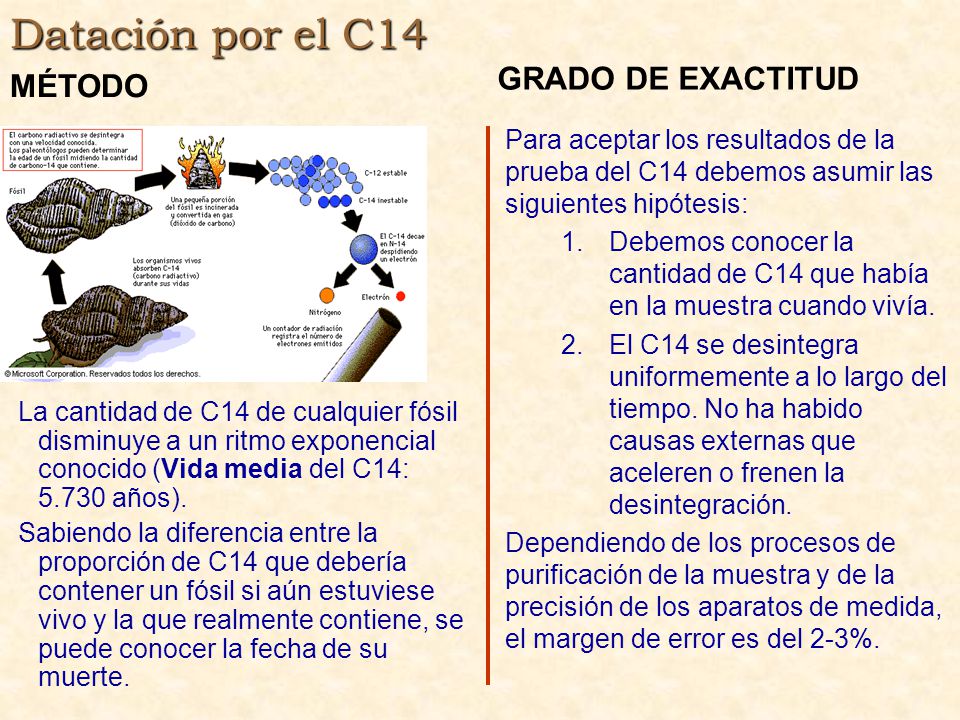
8) Datació amb carboni-14. En què consisteix?
Busca la massa atòmica o pes atòmic del:
- Carboni 12, carboni 13, carboni 14. El resultat s'expressa en unitats de massa atòmica (u). Example: massa atòmica del carboni 12 és 12 u. (És el nombre màssic (A) o pes atòmic de la Taula Periòdica)
- Oxigen 16 i oxigen 18.
- Liti 6, liti 7 i liti 8.
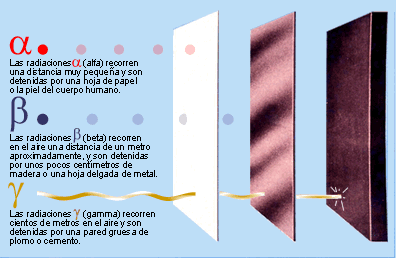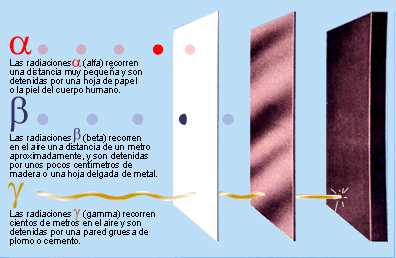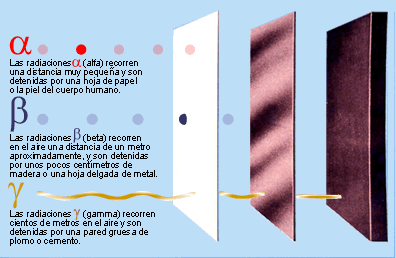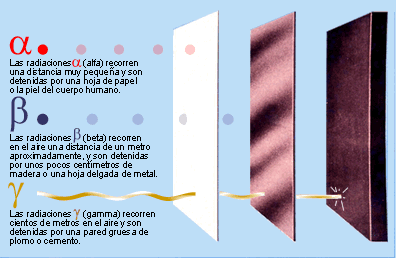
LA RADIOACTIVITAT
Partícules emeses pels elements radioactius
La radioactivitat.La bomba atòmica.Centrals nuclears.
Per a les noies que voleu ser científiques...
Bequerel. Marie i Pierre Curie.
Els protagonistes de la radioactivitat
- Què és la radioactivitat? A quina part de l'àtom afecta?
- Què és la fusió nuclear? I la fissió nuclear? La bomba atòmica i les centrals nuclears fan fusió o fissió? Fes un dibuix de la fissió i la fussió.
- Henry Becquerel, descobridor de la radioactivitat. (Què va fer, quan va néixer, nacionalitat, on va viure)
- Marie i Pierre Curie. (Què va fer, quan va néixer, nacionalitat, on va viure)
- Enrico Fermi. (Què va fer, quan va néixer, nacionalitat, on va viure)
- Albert Einstein. (Què va fer, quan va néixer, nacionalitat, on va viure)
- Projecte Manhattan.
- Comptador Geiger.
- Laboratori nuclear de Los Álamos (Nuevo Mégico).
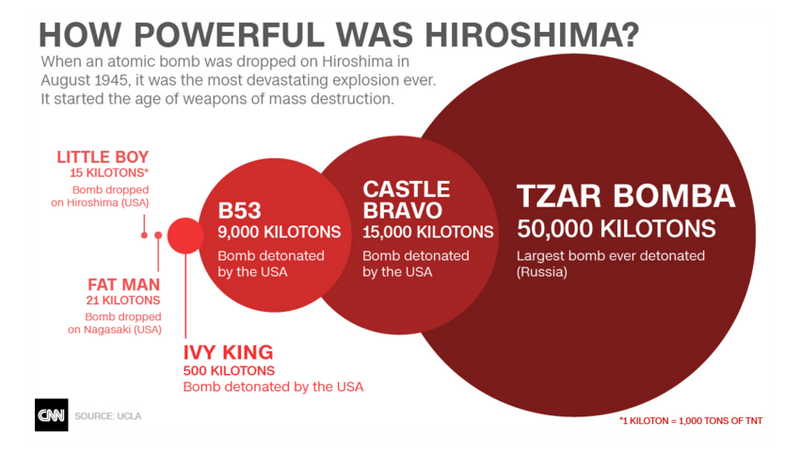
- Little Boy i Enola Gay.
- Fat Man.
- Hiroshima i Nagasaki.
- Bomba atòmica sobre Hiroshima i Nagasaki. De quin element radioactiu estaven formades? Quan es van llançar?
- Planta nuclear de Txernòbil. Quan es va produir l'accident i quines conseqüències va tenir?
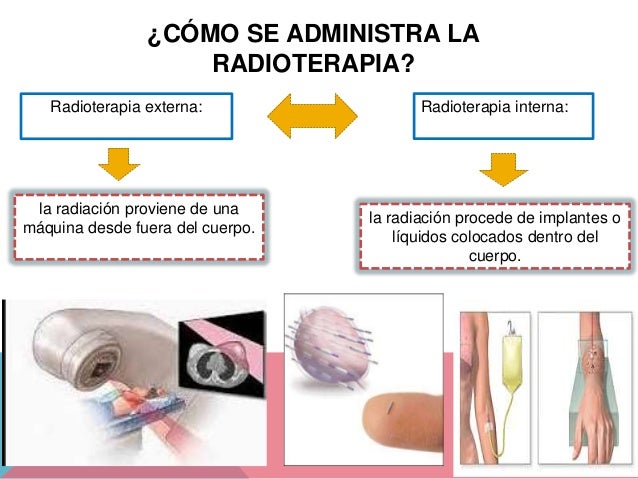
- Aplicacions de la radioactivitat: radioateràpia, datació amb carboni 14.
Per entendre millor el context històric de la bomba atòmica clica aquí. Segona guerra mundial. Guerra del Pacífic. Bombardejos atòmics sobre Hiroshima i Nagasaki, Little Boy. Enola Gay. Fat Man, Hibakusha (testimoni aquí). Liquidadors. La tragèdia de Txernòbil.
Per què Hiroshima i Nagasaki estan habitades i Txernòbil no?
Què és la bomba d'hidrogen? Què és Ivy King?
Després de veure el documental, respon:
1) Quines parts i partícules conté un àtom?
Per què Hiroshima i Nagasaki estan habitades i Txernòbil no?
Què és la bomba d'hidrogen? Què és Ivy King?
"La ruptura del átomo. Chernóbil" La bomba atòmica. Reacció de fissió del nucli d'un àtom.
Després de veure el documental, respon:
1) Quines parts i partícules conté un àtom?
2) Què és la fissió nuclear?
3) Què és l'energia nuclear?
4) De quin àtom estava fet, la bomba Little Boy?
5) D'on ve la capacitat destructora de la bomba atòmica?
6) Quina forma té el núvol radioactiu que forma la bomba atòmica?
7) Creus que és justificable el llançament de la bomba atòmica d'Hiroshima i Nagasaki?
Com funciona el Sol?
Tema 4. Reaccions químiques. Les substàncies es transformen.
Escala de pH
Indicador universal
Font: https://www.shutterstock.com/es/image-vector/ph-scale-universal-indicator-test-strips-1082579132
Col lombarda
Font: https://museodeciencias.unav.edu/documents/11140003/32632495/indicador-ph.pdf/c9941779-a99e-b25e-41e7-0e0da09a0bfc?t=1591191493000
Font: https://www.spanishged365.com/wp-content/uploads/2015/10/1_1.jpg
Font: https://lh3.googleusercontent.com/proxy/9KJ2o2rMHbGyNYLOIp6uy-ndAMaMaUTp4eVcJ2_JFsDPmBnNtlzm-ibVODZxcmo2yOt4-4sirV2BUGCFPyr4YCtlArRFUXgwxwXQGhF6dUjU
Tema. Ones. Llum i so
Font: https://www.proferecursos.com/que-es-una-onda/
Espectre electromagnètic
Font:https://aquiestamosonline.com/wp-content/uploads/2023/09/image-1.png
El so
Ona mecànica que necessita un medi material (aire, aigua, terra...) per transmetre's. No es transmet en el buit. Es transmet més ràpidament en sòlids, líquids que en gasos.
Font: https://avacablog.avacab-audiovisuales.com/wp-content/uploads/2014/04/Audio-Avacab.jpg
Font: https://mariapiano.wordpress.com/wp-content/uploads/2014/03/frecuencia2.gif
Font: https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcTCjnwSS00qCOitUhh1PUidMtZDsCQrGpQjMqF_6Hpy_5v1VKWOWczfZB18Zb1PGO-Nfp4&usqp=CAU
Font: https://cdn0.ecologiaverde.com/es/posts/4/0/8/que_es_la_ecolocalizacion_3804_0_600.webp
Font: https://cdn0.ecologiaverde.com/es/posts/4/0/8/ecolocalizacion_que_es_y_animales_que_la_utilizan_3804_orig.jpg
La llum
Ona electromagnètica que es transmet en el buit.
Font: https://sensing.konicaminolta.us/wp-content/uploads/chart-luz.png
Font: https://i.ytimg.com/vi/yIPg77kNHZM/sddefault.jpg
Tema. Electricitat i magnetisme.
ELECTRICITAT
Font: https://educando.edu.do/portal/wp-content/uploads/2016/01/circuito_serie.jpg































..jpg)